Ácido-base
Babor
Petrucci
- [PETRUCCI 1p703] Defina o explique con sus propias palabras los siguientes términos o símbolos: (a) Kw; (b) pH; (c) pKa; (d) hidrólisis; (e) ácido de Lewis.
- [PETRUCCI 2p703] Describa brevemente cada uno de los siguientes conceptos o procesos: (a) base conjugada; (b) porcentaje de ionización de un ácido o base; (c) autoionización,; (d) comportamiento anfiprótico.
- [PETRUCCI 3p703] Explique las diferencias importantes entre cada par de términos: (a) ácido y base de Brensted-Lowry; (b) [H2O]+ y pH; (c) Ka para NH4+ y Kb para NH3; (d) efecto de nivelación y efecto de atracción de electrones.
- [PETRUCCI 4p703] De acuerdo con la teoría de Brensted-Lowry, ¿cuáles de las siguientes especies espera que sean ácidas y cuáles básicas? (a) HNO,; (b) OCI ; (c) NH, (d) (e) CH,NH+*.
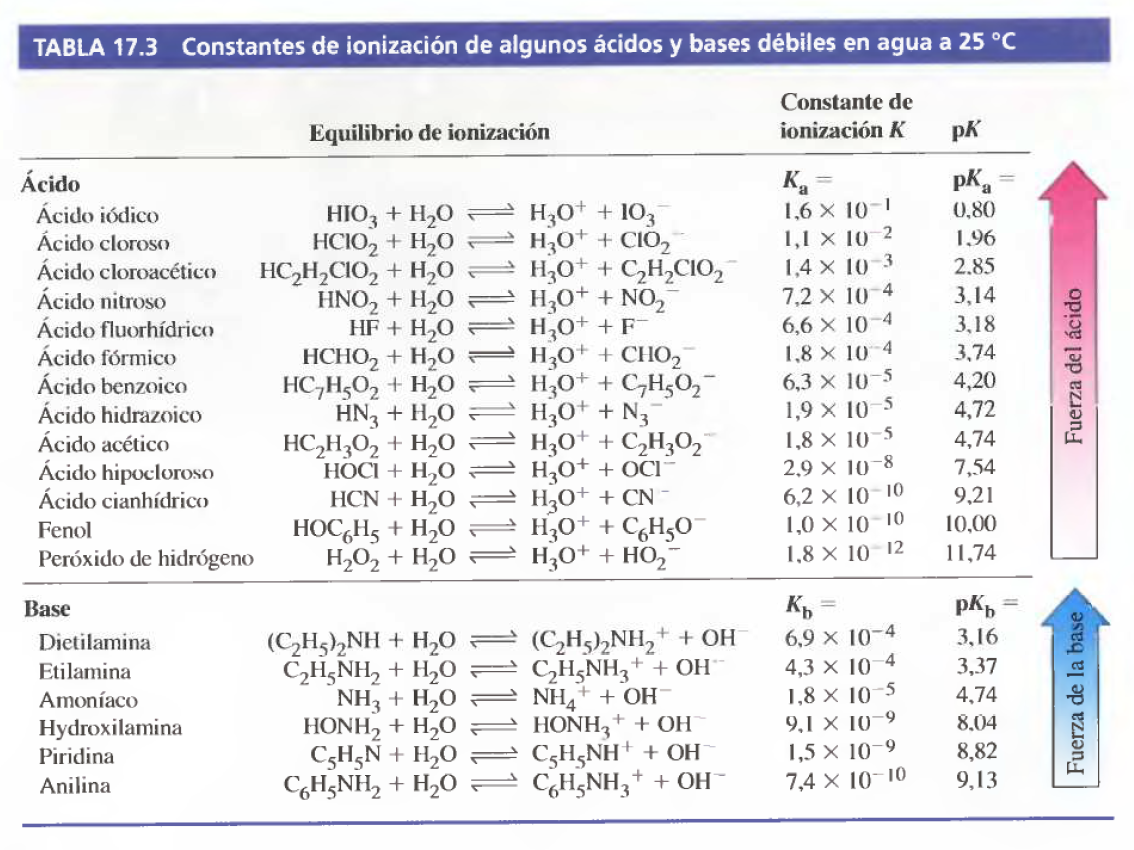
- [PETRUCCI 5p703] Escriba la fórmula de la base conjugada en la reacción de cada ácido con el agua: (a) HIO,; (b) C¿H¿COOH; (c) HPO? ; (d) C2H5NH3+
- [PETRUCCI 6p703] Calcule [H2O+] y [OH-] para cada disolución: (a) HNO3 0,00165 M; (b) KOH 0,0087 M; (c) Sr(OH), 0,00213 M; (d) HI 5,8 x 10*M.
- [PETRUCCI 7p703] ¿Cuál es cl pH de cada una de las siguientes disoluciones? (a) HCI 0.0045 M; (b) HNO, 6,14 X 10* M; (c) NaOH 0.00683 M: (d) Bx(OH), 4,8 x 0
- [PETRUCCI 8p703] Sin hacer cálculos detallados, ¿qué valor espera para [H2O'] en H>SO, 0,10 M: 0,05 M, 0,10 M, 0,11 M, 0,20 M? Justifique su respuesta.
- [PETRUCCI 9p703] ¿Cuál es el pH de la disolución que se obtiene al mezclar 24,80 mL de HNO, 0,248 M y 15,40 mL de KOH 0,394 M? (Sugerencia: ¿qué reacción tiene lugar?, la disolución final ¿es ácida, básica o neutra?)
- [PETRUCCI 10p703] Para una disolución de CH,NH(ag) 0,10 M, sólo una de las siguientes expresiones es correcta: (1) [H2O'] = 0,10 M; (2) [OH-] = 0,10 M: (3) pH < 7; (4) pH < 13. Elija la correcta y justifique su respuesta.
- [PETRUCCI 11p703] Una muestra de 625 mL de una disolución acuosa que contiene 0,275 mol de ácido propiónico, HC,HyO,, tiene [H2O*] = 0,00239 M. ¿Cuál es el valor de K, para el ácido propiónico? HC,HsO, + HO - HO" +
- [PETRUCCI 12p703] Para la ionización de ácido fenilacético, + H¿0 - HO+ + K, = 49 x10* (a) ¿Cuál es la en HC¿H2O, 0,186 M? K,=? (bh) ¿Cuál es el pH de 0,121 M?
- [PETRUCCI 13p703] ¿Qué masa de ácido benzoico, HC¿H¿O, se debe disolver en 350,0 mL de agua para obtener una disolución con un pH - 2,85? HC,Hs0, + HO - HO + C¿Hs0, K, = 63 x 0
- [PETRUCCI 14p703] ¿Cuál debe ser la molaridad de una disolución acuosa de trimetilamina, (CH3),N si su pH = 11,12? (CH,)N + HO - (CH,)NH* + OH K, =63x
- [PETRUCCI 15p703] Para H,CO, 0,045 M, un ácido diprótico débil, calcule: (a) [H2O*], (b) [HCO,"], y (c) [CO,?-]. Utilice los datos de la Tabla 17.4 que sean necesarios.
- [PETRUCCI 16p703] Complete las siguientes ecuaciones en los casos en los que se produzca una reacción de hidrólisis. Indique los casos en los que no se produce reacción. a. NH,'(aq) + NO, (aq) + H2O- b. Na*(aq) + NO, (aq) + HO > c. K"(aq) + C,HsO, (aq) + H2O- d. K'(aq) + a (ap + Na'(aq) + Tíaq) + HO > e. C¿H,NH,'(aq) + Cl (aq) + HO
- [PETRUCCI 17p703] Calcule el pH de una disolución acuosa de NH,Cl 1,68 M. NH¿' + HO - H¡O' + NH, K, = 56 x 10"
- [PETRUCCI 18p703] A partir de los datos de la Tabla 17.3, calcule el valor de (a) K, para C¿H¿NH'; (b) K, para CHO)"; (c) K, para C¿HsO-.
- [PETRUCCI 19p703] Calcule el pH de NaC¿H,C10, 2,05 M. Utilice los datos de la Tabla 17.3 cuando sea necesario.
- [PETRUCCI 20p703] Explique por qué el ácido tricloroacético, CCI,COOH, es un ácido más fuerte que el ácido acético, CH,COOH.
- [PETRUCCI 21p703] Delos siguientes pares de ácidos, ¿cuál es el ácido más fuerte? Justifique su respuesta. (a) HBr o HI; (b) HOCIO o HOBr; (e) 1,CCH,CH,COOH o CH.CH)001COOH.
- [PETRUCCI 22p703] Indique si cada una de las siguientes especies es un ácido o una base de Lewis. (a) OH; (b) (C,H.),B; (c) CH,NH).
- [PETRUCCI 23p703]Las dos reacciones siguientes son del tipo ácido-base de Lewis. ¿Cuál de los reactivos es el ácido y cuál es la hase? Justifique la respuesta. (a) SO, + H2O H¿SO, (b) ZMOH)(s) + 2 OH (aq) -> [Zn(OH), Y (aq)
- [PETRUCCI 24p703] Indique cuál de las siguientes disoluciones acuosas 010 M tiene el pH más alto y cuál el más bajo. Justifique su razonamiento. (a) NH,Cl, (b) NH, (c) NaC¿IKO,, (d) KC1.